무기 늘자 이젠 선택 딜레마? 염증성장질환 시장 '난전'
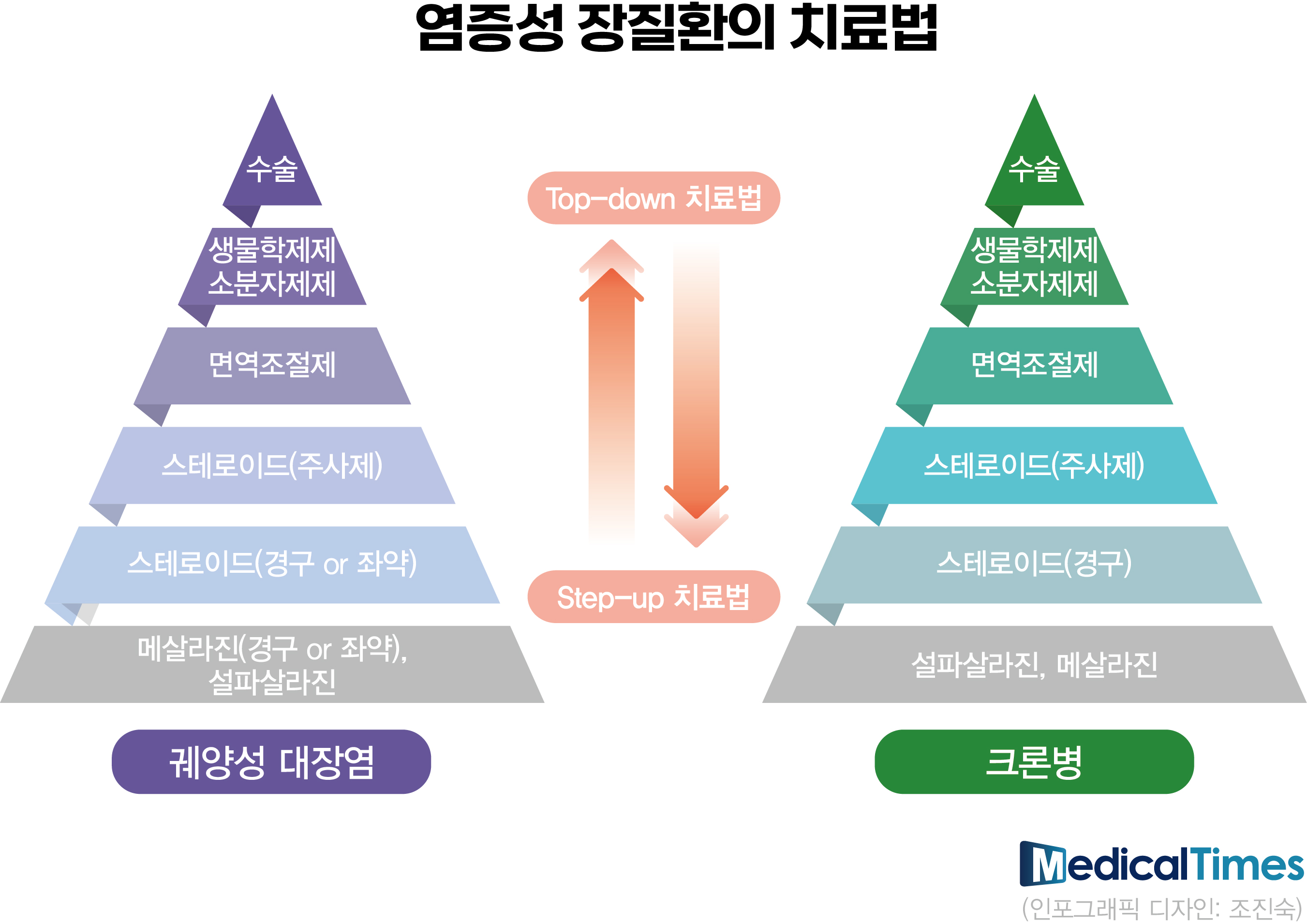
메디칼타임즈=문성호 기자궤양성대장염과 크론병으로 대표되는 '염증성 장질환(Inflammatory Bowel Disease, IBD)'이 최근 급증하면서 적절한 치료전략 마련이 임상현장 화두로 떠오르고 있다.최근 글로벌 제약사 위주 치료제가 건강보험 급여 확대로 임상현장에서의 부담이 낮아진 데에 따른 영향이다. 제약업계에서는 영업‧마케팅 경쟁이 격화되고 있는 상황에서 의학계에서는 적절한 치료제 선택을 위한 가이드라인 개정이 추진될 전망이다.약물 경쟁 각축장 된 IBD그동안 국내 임상현장에서 IBD 치료는 휴미라(아달리무맙), 레미케이드(인플릭시맵) 등 항 종양괴사인자(TNF) 억제제가 점령하고 있었다.8일 제약업계와 의료계에 따르면, 올해 들어 글로벌 제약사들의 치료제가 IBD 치료제 시장에 경쟁적으로 뛰어들면서 빠르게 재편되고 있는 것으로 나타났다.우선 올해 상반기 한국릴리는 식품의약품안전처로부터 인터루킨-23(IL-23) 억제제 '옴보(미리키주맙)'를 허가 받았다. 기존에 유일한 항 인터루킨 제제였던 IL-12/23 '스텔라라(우스테키누맙)'에 더해 또 하나의 IL억제제가 추가된 셈이다.이에 따라 IBD에 처방 가능한 치료제로는 항 인테그린 제제인 '킨텔레스(베돌리주맙, 다케다)'와 항 인터루킨 제제인 '스텔라라', '옴보'에 야누스 키나아제(Janus kinase, JAK) 억제제인 '젤잔즈(토파시티닙, 화이자)', '린버크(유파다시티닙, 애브비)', 지셀레카(필고티닙, 에자이)' 등이 더해졌다.동시에 올해 상반기 중증 환자에서 유일한 경구 치료 옵션이었던 JAK억제제에 더해 S1P(sphingosine-1-phosphate) 수용체 조절제인 '제포시아(오자니모드, BMS)'까지 출시, 급여로 적용되면서 임상현장의 선택지는 더 넓어졌다.최근 애브비 린버크, BMS 제포시아, 에자이 지셀레카 등 염증성 장질환 대표질환인 궤양성 대장염 치료에서의 활용도가 커지고 있다.즉 초기 치료에 실패한 환자들을 대상으로 의료진이 '무기'로 쓸 수 있는 선택지가 한층 넓어진 것이다. 다시 말해, 치료제 선택에 따라 환자 치료의 방향성도 달라질 수 있다는 뜻이다. 이로 인해 임상현장에서는 궤양성 대장염(Ulcerative Colitis, UC)으로 대표되는 IBD 치료제 선택의 문제가 화두가 된 상황이다. 임상연구 결과를 바탕으로 환자별 맞춤 치료가 가능해졌지만, 이로 인한 제약사 간의 경쟁도 한층 치열해진 형국이다.부산의 A대학병원 소화기내과 교수는 "이전에는 항 TNF 억제제 밖에는 무기로 쓸 수 있는 옵션이 IBD에서는 없었다"며 "하지만 최근 들어서는 활용할 수 있는 옵션이 많아졌다. 이로 인해 오히려 의료진 입장에서는 더 머리가 아파진 것 같다"고 말했다.제약업계에서도 치료 선택지가 많아지면서 치료제 우선권을 확보하기 위한 물밑작업이 한창이다. 대표적인 사례를 꼽는다면 BMS의 제포시아로, 국내 영업‧마케팅 강점을 둔 유한양행과 공동판매 협약을 맺은 것이다.한 제약업계 관계자는 "사실 유한양행이 BMS와 제포시아 공동판매 계약을 맺은 것을 두고 상당히 이례적이라는 평가가 많았다"며 "최근 IBD 시장이 치료제가 늘어나면서 경쟁이 치열해진 점과 유한양행도 신약 라인업을 늘려야 한다는 것이 맞아떨어진 협력으로 보여 진다"고 평가했다.약제 순서는? 가이드라인 개정 '주목' 글로벌 제약사의 치료제가 늘어나면서 최근 기존 약제와 신규 약제 간 '순서 설정(Sequencing)'이 임상현장에서 화두가 되고 있다.초기 치료 실패 후 치료제 선택지가 늘어난 것과 동시에 약제 간 교체투여가 허용됐지만 곧바로 바꿀 수 없다는 '딜레마'가 생겼기 때문이다.또 다른 대학병원 소화기내과 교수는 "최근 JAK억제제 계열 치료제와 소분자 제제가 궤양성 대장염 등에 급여가 적용돼 임상현장에서 쓰이고 있다. 다만, 효과가 좋으면 부작용도 있기 마련"이라며 "해당 치료제를 활용했을 때 대상포진 및 혈전 등 합병증이 생길 수 있기 때문에 대상표진 백신 접종 및 상대적으로 젊은 환자에게 활용하고 있다"고 설명했다. 그는 "JAK억제제 계열 중에서는 지셀레카의 경우 아자티오프린 쓰다가 바로 함께 처방 가능한 JAK 억제제로는 유일하다"며 "임상연구 면에서 린버크가 궤양성 대장염과 크론병에서 효과가 뛰어나다. 다만, 다른 JAK 억제제는 처방하려면 아자티오프린을 빼야 하는데, 의사 입장에서는 환자에 효과가 있다고 평가하는데 제외해야 하니까 고민이 된다"고 밝혔다.궤양성 대장염과 염증성 장질환 치료제 활용 순서를 둘러싼 임상현장에서의 갑론을박이 최근 치료제가 늘어나면서 본격화되는 모양새다.즉 환자에게 맞는 치료제를 우선적으로 쓰는 한편, 임상연구를 바탕으로 치료제 순서를 의료진 판단에 따라 현재 정해지고 있는 셈이다. 허가와 급여 근거가 된 임상연구를 바탕으로 가장 효과가 우수하다고 판단이 되는 치료제를 '최후방'에 배치, 마지막 무기로 임상현장에서 활용되고 있는 것으로 나타났다. 다만, 이 같은 방식이 최선은 아니라면서 환자의 질병 정도 및 사회경제적인 상태를 종합적으로 분석해야 한다는 의견이다. 이와 함께 치료제 선택지가 늘어난 만큼 해당 질환 전문 학회인 대한장연구학회의 가이드라인 개정을 지켜봐야 한다는 의견도 존재한다.대한장연구학회 재무이사인 서울아산병원 예병덕 교수(소화기내과)는 "정답이 없기 때문에 항상 고민이 되는 문제다. 특히 린버크의 경우 다른 약제와 비교했을 때 임상 혹은 내시경적 측면에서 우월하기 때문에 최대한 미뤄 놨다 써야 한다는 의견이 있는 것도 사실"이라며 "환자의 개인적인 질병 상태와 사회, 경제적인 면을 종합해서 활용해야 한다"고 설명했다.예병덕 교수는 "린버크도 약을 질병 후반기에 쓰면 효과가 떨어지기 때문에 뒤에 미뤄두는 것도 치료전략 면에서 반드시 좋은 것이라고 볼 수 없다. 질병 초기에 써서 염증을 조절하는 것이 더 좋을 수 있기 때문"이라며 "최종적인 것은 환자와의 상담을 통해 결정해야 할 문제다. 이와 관련해 최근 늘어난 IBD 치료제 관련해서는 장연구학회 가이드라인 개정을 통해 담아낼 예정"이라고 덧붙였다.